用HPLC纯化和分离多肽
用HPLC纯化和分离多肽
RP-HPLC在实验室通常来纯化用于研究目的的微克到毫克量的多肽。内径50mm或更大的色谱柱用于纯化克级量的用于临床试验或商业药品的重组蛋白质。实验室内的放大分离通常包括标准溶剂和离子配对试剂或缓冲液的使用、选择所需加样载负特性的柱子尺寸(见附录A)、以及优化洗脱梯度。
将实验室分离放大到过程规模,不仅要包括增加柱子的尺寸和洗脱速率,还包括洗脱溶液的变化、不同离子配对试剂或缓冲液的使用、以及梯度条件的变化。
在所有情况中,实验室分离的放大可以通过使用用于大尺寸色谱柱的分离材料而得到简化,这些大尺寸柱子和实验室规模常规分离所用柱子的分离特性几乎相同。
分离材料的选择
产程规模反相分离的材料能得到和分析型反相色谱柱几乎相同的分离特性。
VYDAC 300 A的硅胶微粒大小从不到5微米到几乎30微米不等(图40)。通过物理冷上浆来分离5到10微米的微粒碎片,以用于分析和实验室规模的制备分离。
VYDAC TP-300 A 孔径硅胶的粒度分布
图40.硅胶的粒度从小于5微米到30微米不等,有分析、制备和工艺应用等粒度级
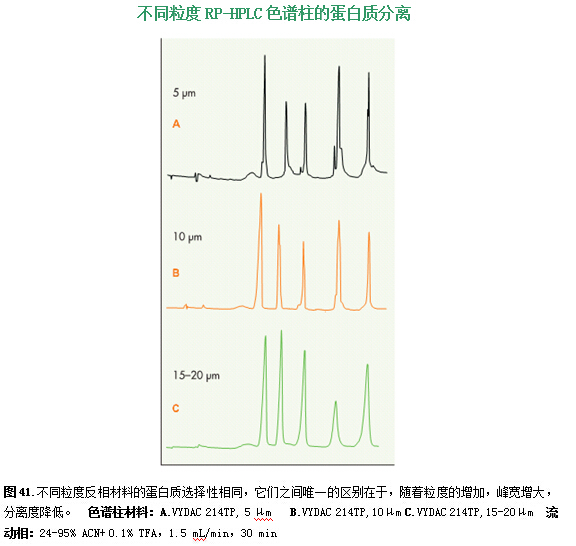
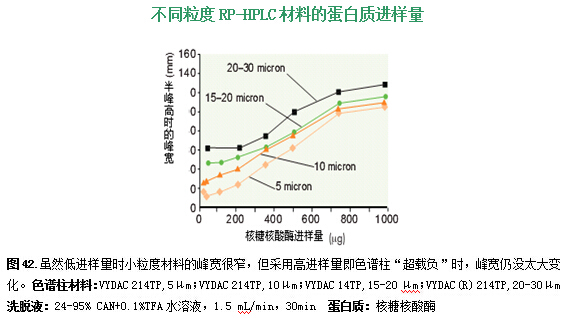
较大平均粒度的硅胶,被分离出用于制备和过程放大的应用。过程放大的反相材料与分析规模材料具有几乎相同的蛋白质和肽选择特性,它的加工工艺与分析型大小的硅胶一样,并通过相匹配的化学处理键合在硅胶上。用5、10和15-20微米粒度材料的色谱柱分离几种蛋白质就说明了这一点(图41)。三种柱子的蛋白质选择性和保留时间是一样的。不同微粒大小的材料的唯一不同点是,大分子材料产生的峰更宽,造成分离度有些丢失。大微粒材料——10-15、15-20或20-30μm——通常用于大规模纯化,因为它们比小分子材料便宜,产生柱压低,而且易于装进大直径柱子中。另外,在制备型色谱中,色谱柱几乎总是“超载负”以得到最大样品通量(见43页)。当色谱柱“超载负”时,大微粒材料和小微粒材料的性能差不多,如图42所示。虽然用5或10微米的材料比用在样品低载负时用更大微粒材料得到的峰宽和分离度要好很多(2-3倍),但是在用典型的“超载负”条件进行高进样载负时,峰宽只比用较大微粒材料的大20-50%左右。柱子超载负时,小微粒轻微的分离度的优势并不能弥补其成本高、柱压高以及在工艺应用中的实际困难。
放大洗脱条件
放大多肽分离时要考虑的三个关键因素是:洗脱溶剂、离子对试剂或缓冲液、以及梯度特性。
洗脱溶剂
实验室规模的纯化通常使用和分析型色谱一样的有机调节剂,即乙腈。
离子对试剂或缓冲液
实验室规模的纯化通常使用和分析型色谱一样的离子对试剂或缓冲液。
梯度特性
增加柱直径时,为了保留分析柱上得到的分离度,必须保持梯度体积的速率为柱体积常数以维持梯度形状。比如,同样长度的直径22mm柱的体积是直径4.6mm柱体积的23倍(22除以4.6,平方)。分析柱以1.0mL/min的梯度走30分钟的体积为30 mL。要把该方法应用到22mm柱上,梯度体积将增加23倍,达690mL。保持梯度时间不变,流速将增加23倍;延长梯度时间,流速也会部分地增加。比如,流速为23mL/min走30分钟,梯度体积为690 mL。但是,以10mL/min的流速走69分钟能得到同样的梯度体积,由此得到同样的梯度形状和同样的样品分离度。在这两种情况下的分离都能与分析柱上得到的相媲美。实际上,梯度常设置得更低——即单位时间内有机调节剂浓度增加较小——以增加分离度,尤其在收集主要多肽时。
过程放大纯化:多于五克的肽
洗脱剂
常用于实验室规模色谱的有机溶剂会引起成本、处理或操作环境中的安全等问题。乙醇等溶剂在过程色谱时更适用一些。乙醇相对来说无毒、与水混合时不易燃、成本低并被FDA等管理机构所熟悉。乙醇目前用于大规模过程纯化。
离子配对试剂或缓冲液
通常用于分析型色谱的离子对试剂不太适用于过程放大色谱。能用于操作色谱的替代离子配对试剂或缓冲液包括乙酸(也能乙酰化多肽,制剂时又用)和磷酸盐。乙酸目前用于几种生物技术多肽治疗剂的分离。
梯度特性
根据大柱子而放大洗脱梯度的实验室规模纯化能用于过程放大纯化(见上),多肽洗脱所用梯度通常都很小。
一针色谱分析中能纯化多少肽?
如果RP-HPLC分离的目的是收集纯化的多肽以备进一步使用,在保持满意的纯度的同时柱子所能载负的样品量就很重要了。制备纯化的方法一般是载负最大可能量的多肽,同时权衡以下三个因素:
通量
给定时间内纯化的多肽量。虽然低载负产生最大的分离度,但每针色谱分析时纯化量较少,通量也较低。
纯度
纯度用最终纯化产物的重量占总重量的百分数来表示。纯的多肽通过避免相邻峰的重合来得到,虽然这会限制柱子能载负的样品量。
产量
纯化后的多肽占初始多肽总量的百分数。最大化分离度可以在除去杂质的同时,回收载负的大部分多肽。如果分离度较低,则收集峰的中间部分,这样就减少了产量。
RP-HPLC柱上的样品容量有三个量度:
■ 最佳分离度时的载负容量;
■ 实际样品载负量
■ 柱子允许载负的最大多肽量。
最佳分离度时样品载负能力
色谱分析中,柱子载负极限通常定义为色谱分析时峰宽增加不超过10%的分析物最大量。
对大多数多肽来说,分析柱(直径4.6mm)在到达“超载负”点前,峰宽和分离度保持不变的样品量在100到200μg 之间(图43)。 样品载负大于这个值时会形成宽峰,造成分离度降低。
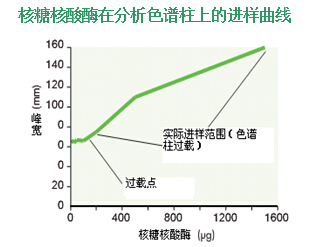
图43.进样量直到200μg时峰宽仍保持不变。大于200μg(“超负载”点)时峰宽慢慢变大。核糖核酸酶的实际进样范围是200-5000μg。 色谱柱:VYDAC 214TP54 (C4, 5 μm, 4.6 x 250 mm) 洗脱液:24-95% ACN+0.1% TFA,30min 样品:核糖核酸酶
实际样品载负量
制备分离需要通过平衡分离度、产量和纯度来最大化通量。通常来说,提高产量是以减少纯度和降低通量为代价的。在实际中,这往往需要是色谱柱“超载负”——也就是多肽进样量多于最佳分离度定义的样品量。随着样品载负增加,多肽的峰宽也随之增加(图43和44),但峰形仍保持对称。这就允许样品载负量可以是定义样品量的10到50倍,而仍能保持可接受的分离度。
在图44中,分别进样25、100、200、500和1000微克的核糖核酸酶和溶解酵素,说明了增加样品载负对峰宽增加的分离度的影响。在25和100μg的进样量时(在最佳分离度的范围内),核糖核酸酶和它前面的小杂质之间的分离度保持不变(图44A,B)。进样量超过100μg(“超载负”点)时,核糖核酸酶和杂质的分离度开始降低。200μg进样量时,峰宽明显增加,导致分离度降低(图44C)。500μg时,分离度显著降低(图44D);1000μg时,杂质峰与核糖核酸酶的峰完全重合(图44E)。
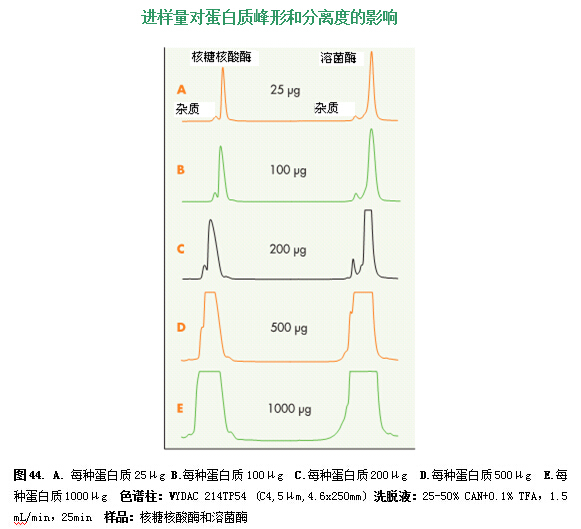
溶解酵素和前面杂质的分离度在200μg时仍保持不变,但之后分离度就逐渐减少了。在500μg时(图44D),杂质峰只出现在溶解酵素峰肩上,1000μg时(图44E),杂质峰和溶解酵素峰就完全重合了。蛋白质和杂质峰可以通过运行一个更小的梯度提高分离度。
由于核糖核酸酶和溶解酵素的分离度甚至在1000μg时仍保持良好,而且峰形没有严重退化,所以在高进样量时也可能得到分离很好的峰。文献中有很多高负载时纯化多肽的实际例子。其中有一例就是用5 x 30 cm的色谱柱纯化1.2克合成多肽混合物。据个人所知,曾有报道用5 x 25 cm色谱柱分两步纯化5克的合成多肽。
多肽最大结合量
多肽在反相色谱柱上的最大结合量取决于多肽的大小和性质。小肽的结合量约为每克分离材料10mg肽——在4.6 x 250 mm色谱柱上结合25mg。较高的肽结合量为每克分离材料10-20mg蛋白质,这取决于疏水脚面积占整个分子量的比例。
虽然接近色谱柱最大结合量的样品量分离度很小,但它们能对多肽样品简单、快速地脱盐。
通量和分离度的优化方法
样品浓度
样品的浓度会影响相邻洗脱的多肽的分离度。稀释的样品比浓缩的样品好像能更好地分布在色谱柱表面,由此产生一些更好的分离度。建议:使用稀释的样品以提高分离度和进样量。
使用小梯度
相邻洗脱的多肽之间可以通过使用较小的梯度斜率提高分离度。常通过延长梯度时间来达到这一点。建议:采用较长的洗脱时间和小梯度以获得相邻洗脱峰的分离度。
增加柱体积
由于进样量是色谱柱体积的函数,所以增加色谱柱直径或柱长都可以增加进样量。重要的是柱体积,而不是柱直径或柱长。
使用大微粒吸附剂
当色谱柱“超载负”时,微粒大小对获得分离度来说就不那么重要了(图42)。小微粒材料在“超载负”条件下的分离度比大微粒材料只有好一点点,但其成本高、柱压高、小微粒材料柱子制备困难等使其对大多数制备分离来说不实用。
有效进样量
在溶剂中进样并不影响多肽的吸附。这一般意味着保持有机质含量低于把多肽从色谱柱上洗脱下来的所需的含量。但是,有些样品中的溶剂能提高进样量。
生物活性与反相HPLC
蛋白质的生物活性取决于它的三级结构,三级结构的永久性断裂会使蛋白质失去活性。
RP-HPLC能破坏蛋白质的三级结构,这是由洗脱所用的疏水性溶剂或是由蛋白质与疏水材料表面的相互作用造成的。生物活性丧失的量取决于蛋白质的稳定性和所采用的洗脱条件。生物活性的丧失可以通过适当的色谱后处理来减少到最小。小肽和非常稳定的蛋白质与大分子酶相比更不容易失去生物活性。
蛋白质变性
蛋白质在疏水性表面的动力学变性很慢。减少蛋白质在色谱柱中的保留时间一般可以减少生物活性的丧失。
溶剂影响
有些溶剂比其它溶剂更不易引起生物活性的丧失。异丙醇是保持生物活性的最好溶剂。乙醇和甲醇有点差,乙腈则引起最大的生物活性丧失。
稳定因子
加进色谱洗脱液中的酶的辅助因子等稳定因子可以稳定蛋白质,减少生物活性的丧失。
保持或恢复生物活性的最重要的因素是柱后样品处理。将收集后的蛋白质用稳定缓冲液溶解能使蛋白质重新折叠起来。HIV蛋白酶就是一例(图45)。

RP-HPLC后仍有生物活性的例子
胰岛素
反相色谱已被用于纯化消化蛋白质的胰岛素。
脊髓灰质炎病毒蛋白质
用反相色谱纯化的脊髓灰质炎病毒蛋白质能引起兔子体内特定抗体的生成,说明其仍保留生物活性。
花粉过敏原
犹大墙草的主要蛋白质过敏原在用RP-HPLC纯化后仍保留IgE粘合能力,因为它是用低浓度乙腈洗脱的。
HIV蛋白酶
HIV蛋白酶经反相色谱和色谱后处理仍保持大部分的生物活性,能够重新折叠(图45)。
使用反相HPLC纯化商业多肽治疗剂
经反相色谱后生物活性并没有不可避免地消失的最明显证据是,在纯化商业药品时对几种商业生物治疗剂的反相色谱分析。
■ 促血红细胞生长素可以用反相色谱纯化,这是纯化过程的一部分。
■ 集落刺激因子(Leukine)是一种商业多肽治疗剂,用反相HPLC作为其纯化过程的一部分。
■ 在生产人类重组改构胰岛素中使用反相色谱纯化。
尽管反相色谱会造成一定程度上三级结构和生物活性的丧失,但在大部分情况下,这种生物活性的丧失可以通过使用最佳色谱条件或色谱后处理来缓和或消除。
大规模纯化的例子
实验室规模的纯化
文献中已有使用RP-HPLC纯化合成多肽的一些例子。其中一个例子是用RP-HPLC分两步从1.2克合成混合物中纯化出128mg的促性腺激素(GnRH)拮抗剂(图46)。该过程如下(详见参考文献46):
1 在5微克、4.6 x 250 mm色谱柱上用三乙酰磷酸盐和乙腈建立洗脱条件;
2 在5 x 30 cm色谱柱上进样合成多肽,柱子用15–20 μm的与步骤1柱子中的5微米材料相当的吸附剂装填,并用乙腈和三乙酰磷酸盐洗脱;
3 分析收集组分的纯度和产量,合并最佳组分以备脱盐化和最终纯化;
4 稀释,在同一柱子上重新进样;
5 用乙腈和TFA洗脱以除去不挥发的磷酸盐,进一步提高分离度;
6 分析收集组分的纯度和产量;
7 合并最佳组分,最终得到128毫克的促性腺激素(GnRH)拮抗剂,纯度为99.7%。
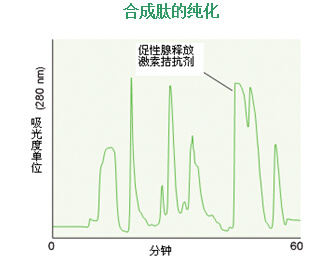
图46.进样纯化128mg合成肽,促性腺释放激素拮抗剂1.2克合成混合物,用5 x 30 cm色谱柱,填料VYDAC 218TPB1520(C18, 15–20 μm),用含磷酸三乙基胺的乙腈水溶液洗脱。
反相HPLC纯化中有毒微粒的除去
在制备大量治疗性蛋白质过程中插入反相色谱分离步骤的一个好处是可以从蛋白质“汤”中除去或清除病毒。
最新消息
- 1赛多利斯新品Practum系列天平
查看次数:1283079......
- 22014年中国和世界十大科技进

由中国科学院、中国工程院主办,中国科学院院......
- 3天美中国与国家纳米科学中心

5月29日下午,天美(中国)科学仪器有限公司与......
- 4分析天平应该如何选砝码以及

查看次数:1107677 分析天平应该如何选砝......
- 5电子天平的使用与维护方法

电子天平是最新一代的天平,是根据电磁力平衡......
