反相HPLC多肽分离中流动相和温度的作用
反相HPLC多肽分离中流动相和温度的作用
把多肽从RP-HPLC柱子上脱附和洗脱下来用的是含有机调节剂和离子对溶剂或缓冲液的水溶剂。有机调节剂把多肽从疏水性表面溶解并脱附下来,同时离子对试剂或缓冲液调节洗脱pH值,并与多肽相互作用以加强分离。洗脱采用的是逐渐提高色谱时有机溶剂浓度(溶剂梯度)的方法。当溶剂达到能引起脱附的浓度时,多肽就从色谱柱子上脱附并洗脱下来。
有机调节剂
有机试剂的作用是把多肽分子从疏水性的吸附表层脱附下来,慢慢升高有机溶剂的浓度(梯度),直到多肽脱附并洗脱下来。
乙腈(ACN)
乙腈(ACN)是最常用的有机调节剂,这是因为它:
■ 易挥发,容易从收集的组分中除去;
■ 粘度低,柱压小;
■ 短波几乎无紫外(UV)吸收;
■ 经长期使用证明,其在RP-HPLC多肽分离中可靠。
异丙醇
异丙醇常用于大分子蛋白质或非常疏水的蛋白质。异丙醇的主要缺点是粘度大。为了降低异丙醇的粘度而保持其疏水性,我们建议使用乙腈:异丙醇为50:50的混合液。在有些情况下,在乙腈中加1-3%的异丙醇能增加蛋白质的回收率。
乙醇
乙醇常用于过程规模纯化。乙醇是一种优良的RP-HPLC的溶剂,它价格低,与FDA等管理机构所熟悉。乙醇已用于洗脱疏水性的跨膜蛋白质,也用于纯化处理。
甲醇或其它溶剂
甲醇或其它溶剂与常用的溶剂相比没有什么优点,而且不用与多肽分离。
洗脱梯度
洗脱多肽几乎总使用梯度溶剂。慢慢增加有机溶剂的浓度,能得到最尖锐的峰和最好的分离度。
多肽分离通常首选梯度洗脱。等度洗脱往往产生宽峰,所以等度洗脱时最好选用非常小的梯度。典型的溶剂梯度是每分钟有机调节剂浓度增加的斜率为0.5-1%。像每分钟0.0 5-0.1%这样极低的梯度能获得最大的分离度。图1(见第2页)中胰岛素变异物的分离所用的梯度斜率每分钟只有0.25%。图17表明,对蛋白质来说,减少梯度的斜率通常能提高分离度。
采用低梯度时酶亚基分离度提高
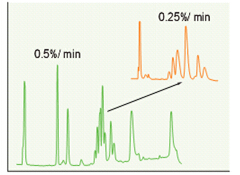
图17.色谱柱:C18 (VYDAC 218TP104) 流速:1 mL/min 洗脱液:如图所示梯度,梯度从25%到50%ACN的TFA水溶液。 样品:细胞色素C氧化酶亚基。 数据来自参考文献21。
为了达到最佳重现性和平衡,要避免使用极限浓度的有机调节剂。我们建议,有机调节剂的起始浓度不要低于3-5%。起始浓度低的有机调节剂梯度会因为柱子表面很难“润湿”,而引起色谱柱平衡时间过长或没有重现性。我们建议有机调节剂的结束梯度不要超过95%。有机浓度过高会洗去全部有机相上的水,也会使柱平衡更加困难。
梯度斜率对肽选择性的影响
由于有些肽和反相柱子表面发生作用的方式有微小的差异,所以溶剂梯度的斜率可能会影响肽的选择性,由此影响肽之间的分离度。
通过在不同的梯度时间,用不同的梯度斜率分离人生长激素的胰蛋白酶消化物,可以很好阐明这种影响。图18中是在三种不同的梯度斜率(时间),对人生长激素的胰蛋白酶消化物一些碎片的分离。随着斜率的降低,碎片9和10的表现和预期的一样,即分离度随着梯度斜率的降低(梯度时间增加)而提高。但是,碎片11和12表现不同。分离度随着梯度斜率的降低而减小,这表明改变梯度斜率时选择性发生了变化。如果要改进方法并考查该方法对每一肽对的影响,当温和地改变梯度斜率时,要对这种影响进行监控。
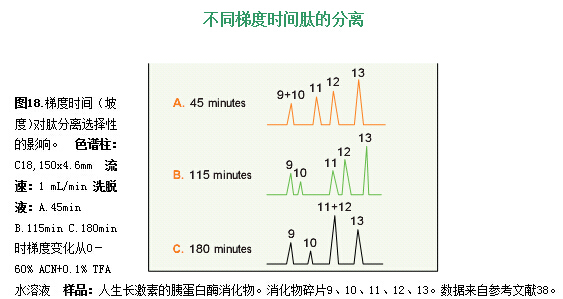
离子对试剂和缓冲液
离子对试剂或缓冲液调节洗脱pH值,并与多肽作用,从而加强分离。
三氟乙酸
应用最广的离子对试剂是三氟乙酸(TFA),其应用广泛的原因是:
■ 易挥发,易于从收集组分中分离;
■ 短波段几乎无紫外(UV)吸收;
■ 经长期使用证明,其在RP-HPLC多肽分离中可靠。
TFA通常使用的浓度为0.1%(w/v)左右。0.5%的TFA浓度用来溶解更大分子的或更疏水的蛋白质;低浓度的TFA则偶尔用于胰蛋白酶消化物的分离。虽然新发展的色谱柱允许使用更低浓度的TFA,但当TFA浓度低于0.1%时,蛋白质的色谱图峰形会退化(见28页)。
若用TFA浓度不变的洗脱梯度,当在210-220nm检测时,有时会出现基线漂移。
水溶剂到非水溶剂的介电常数的变化会影响π–π电子相互作用,反过来影响190-250nm范围的吸收光谱,导致在很多反相分离中出现基线漂移。为了减少或消除由TFA光谱吸收造成的基线漂移,尽可能把波长调整到215nm,并在B液中比A液少加15%的TFA以补偿基线漂移。比如,A液中用0.1%的TFA,B液中用0.085%的TFA。
使用质量好的和小量的TFA很重要。劣质的或过期的TFA可能会含有杂质,这些杂质在色谱图中会出现假峰(见附录B)。
TFA浓度对选择性的影响
三氟乙酸的浓度会影响特定肽对的选择性或分离度。
虽然流动相中TFA的浓度通常在0.05-0.1%之间,但改变TFA的浓度也会对肽的选择性产生微小的影响,见图19。这就意味着,要得到好的重现性,在肽分离方法中,谨慎控制TFA的浓度很重要。这也提供了优化肽分离度的另一种方法。选择了色谱柱和梯度条件后,通过轻微改变TFA的浓度,能进一步优化肽对之间的分离度。
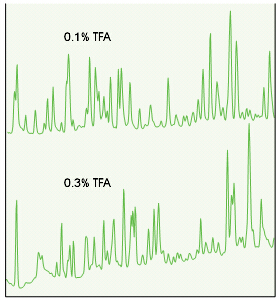
图19.TFA浓度不同造成肽分离模式产生明显的差异。 色谱柱:C18 (VYDAC 218TP54) 流速:1 mL/min 洗脱液:TFA水溶液中梯度变化0-50% CAN,浓度如图所示。 样品:脱铁转铁蛋白的胰蛋白酶消化物。 注:图中显示的是色谱图的一部分。
虽然TFA广泛用于离子对试剂,但使用其它试剂也能得到比TFA更高的分离度。在对五种小肽的分离中(图20),有些肽用磷酸盐得到了比用TFA更尖的峰,使催产素与缓激肽的洗脱顺序颠倒了过来。最后三个峰用磷酸盐比用TFA要更尖,这是因为磷酸盐与碱性侧链发生了反应,增加了肽的硬度。缓激肽在用磷酸盐时比用TFA洗脱得早,因为TFA与缓激肽中的两个精氨酸发生配对,导致保留时间相对延长。另外,在TFA分离时隐藏着的两个小杂质,在用磷酸盐分离时显现出来了(图20B)。盐酸也颠倒了催产素与缓激肽的洗脱顺序,并分离出用TFA时看不见的杂质(图20C)。
肽分离时TFA及替代性离子配对试剂/缓冲液的比较
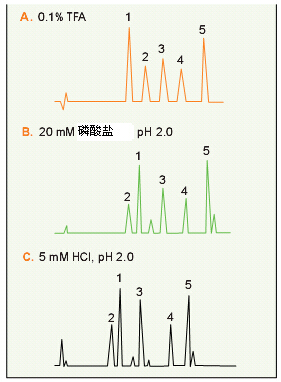
图20.使用TFA(A)、磷酸盐(B)、HCl(C)作为缓冲液/离子配对试剂洗脱五种肽。 色谱柱:VYDAC 218TP54 (C18,5μm, 4.6x250mm). 洗脱液:15-30% CAN,1.0 mL/min,30 min加 A. 0.1%TFA B.20mM磷酸盐,pH2.0 C.5mM HCl,pH 2.0 肽:1.催产素 2.缓激肽 3.血管紧张素II 4.神经紧张素 5. 血管紧张素I。
七氟丁酸(HFBA)能有效地分离碱性蛋白质,三乙胺磷酸盐(TEAP)已用于制备分离。有研究表明,用TEAP比用TFA的样品容量大。10-60%浓度的甲酸已用于非常疏水性多肽的色谱分析。甲酸也用于肽的LC/MS分离,因为TFA降低了电喷雾接口的离子信号;挥发酸、甲酸已被证明在肽的LC/MS中很有效(见26-29页关于LC/MS的详细讨论)。Guo及其同事比较了TFA,HFBA和磷酸在肽洗脱中的使用,发现它们都有不同程度的选择性。
pH对肽分离的影响
由于酸性或碱性侧链的质子化或去质子化作用,肽分离对洗脱pH通常比较敏感,如图21所示。pH4.4时(图21B)五种肽都比在pH2.0时(图21A)洗脱得早,肽的保留时间也相对发生变化。这是肽中酸性基团的电离造成的。缓激肽和催产素在pH2.0时分离得很好,但在pH4.4时同时洗脱。pH6.5时(图21C)肽的保留时间比在pH4.4时要长,但洗脱顺序有很大不同,血管紧张素II,在pH2.0-4.4时第三洗脱,现在第一洗脱出来了。神经紧张素比催产素早洗脱,缓激肽与神经紧张素同时洗脱。这说明,pH对肽选择性产生很大影响,能作为优化肽分离的工具。
合成聚合物反相材料将实际pH的范围扩大到将近pH14(见13页的图13)。如图22所示,肽在高pH值时与低pH值时的洗脱有很大不同。在pH值从2变到9时,样品中肽的洗脱顺序发生了明显的改变。
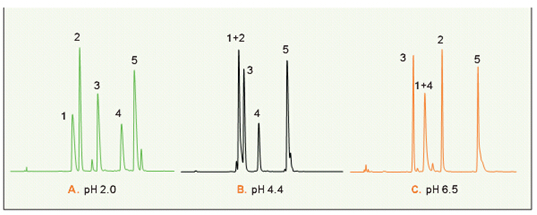
图21.用磷酸盐作缓冲液,pH在2.0、4.4、6.5时五种肽的洗脱。 色谱柱:VYDAC 218TP54 (C18,5μm,4.6x250mm). 洗脱液:15–30% CAN,1.0mL/min,30min;加A. 20 mM磷酸盐,pH 2.0 B.20mM磷酸盐,pH 4.4 C.20mM磷酸盐,pH 6.5 肽:1. 缓激肽 2.催产素 3. 血管紧张素II 4.神经紧张素 5.血管紧张素I.
用HPLC从蛋白质消化物中分离肽碎片的操作条件
虽然大部分酶标记操作使用0.1%TEA作为李子配对试剂,但用别的离子配对试剂或高pH有时能得到更好的分离度。
TFA广泛用作离子配对试剂,也是肽分离的最好起始点。但是也要考虑使用磷酸盐或盐酸等缓冲液,或研究pH的影响,以优化肽的分离。为了测试pH的影响,配制100mM磷酸盐溶液(pH约4.4)。取三分之一用磷酸调整到pH2.0,三分之一用NaOH调整到pH6.5。然后稀释每份溶液至10-20mM用作洗脱缓冲液。用TFA测肽的分离度,这三份磷酸盐缓冲液(pH2.0,pH4.4,pH6.5)和盐酸都是为了实现良好的肽分离而寻找最优试剂和pH条件的很好的方法。
合成聚合物(聚苯乙烯-二乙烯苯基)色谱柱在低和高pH时对肽的分离
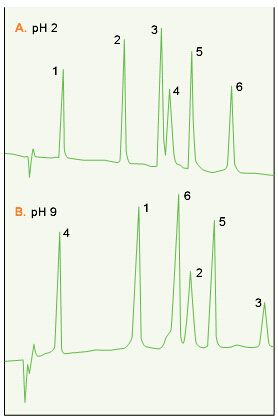
图22.色谱柱:VYDAC 259VHP5415 (PS-DVB,5μm,4.6x150mm) 洗脱液:15–30% CAN,15 min,加A.0.1% TFA pH 2. B. 15 mM NaOH, pH 9. 流速:1.0 mL/min 肽:1.催产素 2.缓激肽 3.神经紧张素 4.神经紧张素1-8 5.血管紧张素III. 6. val-4 血管紧张素III
流动相流速
流速对多肽分离没有什么影响。流速不影响多肽从反相表面脱附和之后的保留时间。
只有有机调节剂浓度达到一定浓度时,多肽才发生脱附。所以蛋白质的分离,相对地不受流动相流速的影响。
洗脱流速会影响小肽的分离度,这是因为小肽在RP-HPLC色谱柱上的行为介于蛋白质和小分子之间(见第4页)。Stone和Williams发现,从羧甲基转铁蛋白的胰蛋白酶消化物中分离出的肽碎片的数量取决于洗脱流速。在分析型HPLC色谱柱上,流速0.2mL/min时,只分离出不到80个肽碎片,而流速为0.8 mL/min时能分离出116个肽碎片。流速在0.5-1.0mL/min之间,分离出的肽碎片数量没有什么变化。
要注意的是,精炼小肽分离时分离度是有限的,可以通过较小的洗脱流速的变化来获得分离度微小的提高。流速也会影响分离的其它方面,比如:
检测灵敏度
低流速只能洗脱小量的多肽,吸附与敏感度也因此增加。HPLC窄径色谱柱能提高检测灵明度,这主要是因为它能在低流速下运行,洗脱多肽所用溶剂的量也很小。
样品溶解性
高流速能提高熟水性多肽的溶解性,虽然这样也会增加纯化该样品的溶剂用量。
柱压
柱压与流速有直接的关系。流速越大,柱压越高。
梯度
流速的变化会影响梯度斜率与峰形,这取决于硬件的配置。由于多肽分离对梯度条件敏感,调整流速会改变其对梯度斜率的影响而改变分离度。
温度对肽分离的影响
柱温会影响溶剂粘度,柱压和保留时间,也会影响肽的选择性。
肽做色谱时温度是一个重要的分离参数。在每个HPLC方法中,应该优化温度分离多肽。如图23所示的是从人生长激素的胰蛋白酶消化物中分离碎片。20oC时,碎片11、12、13几乎同时洗脱。随着温度的升高,碎片13的保留值比碎片11、12要长,所以40oC时这三者的分离度很好。但60oC时,碎片11和12同时洗脱,说明了随温度升高,选择性的变化。在20oC时,碎片15比碎片10洗脱得早,40oC时它们几乎同时洗脱,60oC时碎片10首先洗脱,两者得到很好的分离。这些结果说明了温度对肽选择性的重要影响。
温度对肽分离的影响
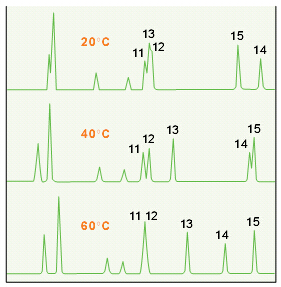
图23.色谱柱:C18, 4.6 x 150 mm 流速:1 mL/min. 洗脱液:梯度渐变 0–60% CAN+1% TFA水溶液,60 min。 温度:如图所示 样品:人生长激素的胰蛋白酶消化物。 数据来自参考文献39。
最新消息
- 1赛多利斯新品Practum系列天平
查看次数:1283079......
- 22014年中国和世界十大科技进

由中国科学院、中国工程院主办,中国科学院院......
- 3天美中国与国家纳米科学中心

5月29日下午,天美(中国)科学仪器有限公司与......
- 4分析天平应该如何选砝码以及

查看次数:1107677 分析天平应该如何选砝......
- 5电子天平的使用与维护方法

电子天平是最新一代的天平,是根据电磁力平衡......
