T920测试电抛液中磷酸、硫酸的含量
T920测试电抛液中磷酸、硫酸的含量
1.实验原理:磷酸是三元弱酸,用强碱中和时可以出现两个当量点,因此,在硫酸和磷酸的混合液中,可用氢氧化钠先后滴定出两种酸的含量。反应式如下:
H2SO4+2NaOH=NaSO4+2H2O
H3PO4+NaOH=NaH2PO4+H2O
用氢氧化钠继续滴定,反应如下
NaH2PO4+NaOH=NaH2PO4+H2O
根据两次滴定耗用氢氧化钠的量可以计算出两种酸的含量。
H3PO4g/kg=V2×CNaOH×98/m
H2SO4g/kg=(V1-V2)×CNaOH×49/m
2.试剂与仪器:
NaOH标准滴定液(1.0mol/L);KF(100g/l);T920滴定仪
3.实验步骤:
用万分之一的电子天平准确称量0.6000电抛液于小塑料杯中,加入10mlKF(100g/l),用标定好的1.0mol/l的NaOH进行滴定,当滴定到PH=5.7时,记录下消耗NaOH的体积V1,继续滴定到PH=8.7时,记录下消耗NaOH的体积V2(不包括V1)。
4.实验数据:
电抛液中磷酸、硫酸含量:

5.仪器参数设置:

三、实验步骤
用万分之一的电子天平准确称量0.6000电抛液于小塑料杯中,加入10mlKF(100g/l),用标定好的1.0mol/l的NaOH进行滴定,当滴定到PH=5.7时,记录下消耗NaOH的体积V1,继续滴定到PH=8.7时,记录下消耗NaOH的体积V2(不包括V1)。
最新消息
- 1赛多利斯新品Practum系列天平
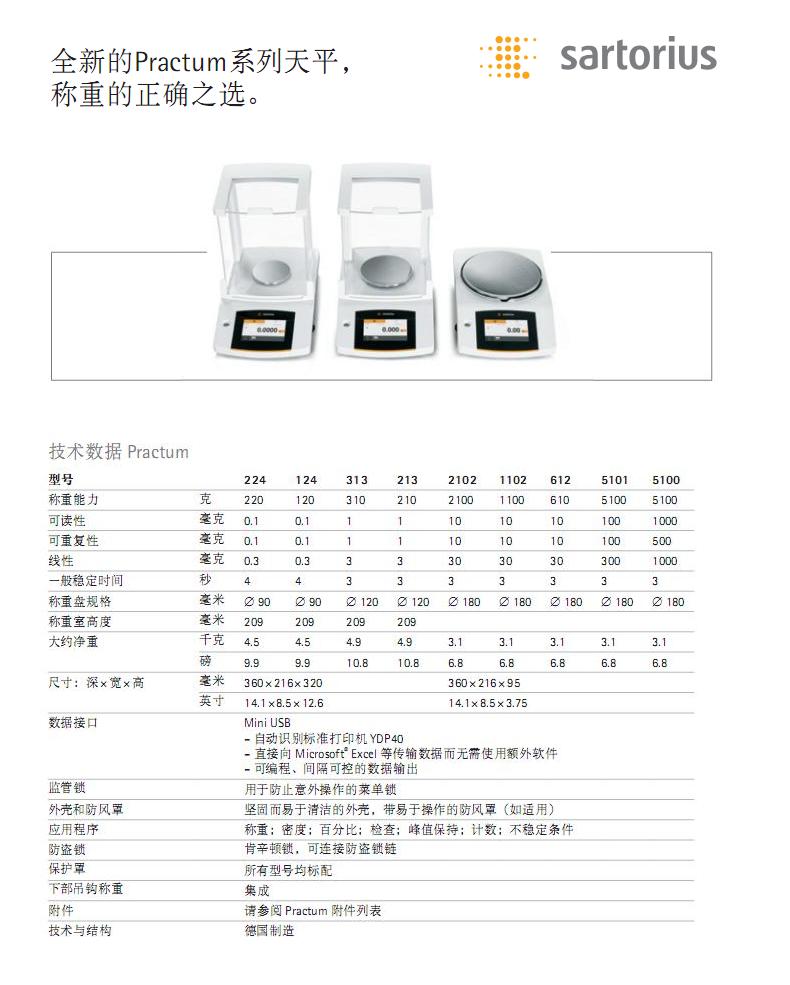
查看次数:1283079......
- 22014年中国和世界十大科技进

由中国科学院、中国工程院主办,中国科学院院......
- 3天美中国与国家纳米科学中心

5月29日下午,天美(中国)科学仪器有限公司与......
- 4分析天平应该如何选砝码以及

查看次数:1107677 分析天平应该如何选砝......
- 5电子天平的使用与维护方法

电子天平是最新一代的天平,是根据电磁力平衡......
