硫化物的测定-电位滴定法
硫化物的测定-电位滴定法
1 范围
本法适用样品中硫离子浓度范围 10-1~103mg/L,检测下限浓度为0.2mg/L。经六个以上实验室验证本法可用于制革、化工、造纸、印染等工业废水以及地表水中硫离子含量的测定。工业废水大多色深、浑浊,含有机物、阳离子、阴离子,成份复杂;且硫离子极易被氧化,不易保持稳定的浓度。
本法不受色深,浑浊的影响Hg2+、 Ag+、 Cu2-、 Cd2+等干扰测定。加入抗氧缓冲溶液(SAOB),可防止硫离子的氧化。SAOB 溶液中含有水扬酸,能与多种金属离子如Fe3+ 、Fe2+ 、Cu2+、Cd、 Zn2+、 Cr3+等生成稳定的络合物,也能与Pb2+络合,但很不稳定。故能游离出金属硫化物中的硫离子于溶液中。SAOB 溶液中的抗坏血酸能还原Ag+ 、Hg2+ 。阴离子CN- 、SH-的干扰可在滴定前加入几滴丙烯腈的异丙醇(10 %)溶液予以消除阴离子Cl-、 SO42- 、SiO32- 、SO32-、S2O32- 、PO43-等不干扰本法测定。若水样中含有胶体,如栲胶等存在,在滴定前加入约0.2g固体硝酸钙破坏胶体。
2 原理
用硫离子选择电极作指示电极,双桥饱和甘汞电极为参比电极,用标准硝酸铅溶液滴定硫离子,以伏特计测定电位变化指示反应终点。
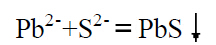
硫化铅的溶度积[Pb2+][S2-] =1×10-28 。等当点时硫离子浓度为10-14mol/L,若在等当点前[S2-] =10-6mol/L,此时浓度变化8 个数量级根据能斯特方程:

式中 E——电极电位;
E0——标准电极电位;
as2-——硫离子活度
从方程中看出硫离子浓度变化8个数量级时,电位变化29× 80mV 在终点时电位变化有突跃。用二阶微分法算出硝酸铅标准溶液的用量,即可求出样品中硫离子的含量。
3 试剂
3.1 0.1000mol/L 标准硝酸铅溶液
准确称取分析纯硝酸铅33.120g,溶于去离子水中转移到1000mL 容量瓶中,并稀释至标线用时可将此溶液再准确稀释成0.0100mol/L 或0.0010mol/L的标准溶液。
3.2 标准硫化钠溶液
取硫化钠晶体(NaS9H2O) 用去离子水冲洗表面,配成1×10-2mol/L的溶液该浓度用标准硝酸铅溶液来标定。
3.3 SAOB(硫化物抗氧缓冲溶液)贮备液
溶解80g 氢氧化钠于500mL 去离子水中,慢慢加入320g 水扬酸钠搅拌至所有固体溶解后,再加入72g 抗坏血酸并加水至1L ,通氮气5min除氧后用塞子塞紧放于暗处备用。此溶液可保存1.5 个月,当此溶液变黑时即失效。若无氮气亦可用新煮沸并冷却的去离子水配制。先将氢氧化钠和水扬酸钠配好用时再按比例加入抗坏血酸。
3.4 SAOB(1+1) 取上述贮备液与等体积去离子水混合。
4 仪器
4.1 精密酸度计或毫伏计
4.2 硫离子选择电极
注 电极转换系数在90 以上或级差为27mV 以上的即可用。
4.3 双盐桥饱和甘汞电极
2
4.4 电磁搅拌器
4.5 微量滴定管10.0mL 或5.0mL(1/10 或1/20 刻度)
5 试样制备
采集水样时,应立即准确加入等体积SAOB(50 )溶液用塞子塞紧瓶口样品应尽块分析水样在3 天内其被测组分浓度下降3
6 操作步骤
吸取上述试样 50.00mL 于100mL 烧杯中放入搅拌子将烧杯置于电磁搅拌器上插入
硫离子选择电极和双盐桥饱和甘汞电极开动搅拌器搅拌以不起漩涡为宜将滴定管的管
尖刚好插入液面(如不够长可按一个尖嘴玻管) 慢慢加入标准硝酸铅溶液同时记录电位
值当电位发生突变后再加入0.1mL 滴定液记录电位值和消耗标准硝酸铬溶物体积数(mL)
注 使用标准硝酸铅溶液的浓度应根据水样中硫化物浓度确定如表1 所示
表1 标准硝酸铅的浓度
使用 Pb(NO3)2 浓度(mol/L) 适合的硫化物浓度(mg/L)
10-1
10-2
10-3
103~102
102~10
10~10-1
7 结果计算
先以二阶微分法求出 Pb(NO3)2 溶液的终点时准确体积数
例 准确吸取50.00mL 试样(实际水样为25.00mL)用0.0100mol/L 的Pb(NO3)2 溶液滴定
其记录为
Pb(N03)2 (mL) 0.00 0.10 0.20 0.30 0.40 0.50
电位 (mV) 720 712 685 456 452 449
一阶微分 8 27/0.1 229/0.1 4/0.1
二阶微分 -202/0.12 225/0.12
终点时二阶微分为零 故在一与+ 之间其终点体积在0.20~0.30mL 之间
上述微分可简化写成
712 685 456 452
27 229 4
-202 +225
V=0.2+202/ 202+225 0.10=0.247
接着可求出水样中硫离子含量为
M V 32.06 1000/ V 试mg/L
式中 M 标准Pb(NO3)2 溶液浓度(mol/L)
V 标准Pb(NO3)2 溶液滴定的准确值(mL)
V 试水样体积(mL)
将数值代入计算 求出硫化物含量为
V 0.10 0.247mL
427
0.10 0.20 202
(0.1)
225
(0.1)
202
(0.1)
202
0.20
2 2
2
´ = + ´ =
+
= +
3
0.0100 0.247 32.06
25.00
1 1000 3.16(mg/L)
8 精密度和准确度
13 个实验室对工业废水中硫化物浓度101~103mg/L 范围测定的相对偏差为3 回收率
为95 以上
注意事项
(1) 标准硫化钠溶液的配制 用于本方法的验证与回收率试验当用碘量法标定Na2S 溶液浓度时因
Na2S 中杂质含量将耗用碘故标定数据要加以校正
(2) 抗氧化缓冲溶液中的水扬酸钠可用 Na2-EDTA 盐代替即溶解120g 氢氧化钠和186gNa2-EDTA盐
于600mL 水中定容至1L 贮于塑料瓶中用时将抗坏血酸量按取此液100mL 7.2g 加入此液可使用较
长时间
(3) 因为是沉淀反应 为了保护和清洗电极方便滴定样品中硫化物的浓度不宜太高该法的测定下限
一般可到5 10-6mol/L
9 参考文献
水和废水监测分析方法 编委会编水和废水监测分析方法第三版pp. 333~335
中国环境科学出版社北京1997
最新消息
- 1赛多利斯新品Practum系列天平
查看次数:1283079......
- 22014年中国和世界十大科技进

由中国科学院、中国工程院主办,中国科学院院......
- 3天美中国与国家纳米科学中心

5月29日下午,天美(中国)科学仪器有限公司与......
- 4分析天平应该如何选砝码以及

查看次数:1107677 分析天平应该如何选砝......
- 5电子天平的使用与维护方法

电子天平是最新一代的天平,是根据电磁力平衡......
