明矾中铝含量的测定
明矾中铝含量的测定
摘要 明矾中铝含量的测定,不宜采用直接滴定法。因为Al3+对二甲酚橙指示剂有封闭作用,且Al3+与EDTA络合缓慢,需要加过量EDTA并加热煮沸,络合反应才比较完全,且在酸度不高时,Al3+水解生成一系列多核氢氧基络合物,如[Al2(H2O)6(OH)3]3+,[Al3(H2O)6(OH)6]3+等,即使将酸度提高至EDTA滴定Al3+的最高酸度,仍不能避免多核络合物的生成。铝的多核络合物与EDTA络合缓慢,且络合比不恒定,对滴定不利。为避免上述问题,可采用返滴定法。如先加一定量过量的EDTA标准溶液,在pH≈3.5时,煮沸溶液,由于此时酸度较大,故不利于形成多核氢氧基络合物,又因EDTA过量较多,故能使Al3+与EDTA络合完全,络合完全后,调节溶液pH至5~6,(此时AlY稳定,也不会重新水解析出多核络合物),加入二甲酚橙,即可顺利的用Zn2+标准溶液进行返滴定。该测定方法简便易行且准确度较高,基本符合实验要求。
关键词 明矾[KAl(SO4)2·12H2O],返滴定法,酸度,二甲酚橙指示剂,铝,EDTA(Y)溶液
Aluminum alum Determination
Abstract alum in the determination of aluminum, not by direct titration. Al3 + because of the XO, and other indicators have closed, and Al3 + and EDTA complex slow, the need to increase heat and boil over EDTA, the reaction is rather complex fully, and when the acidity is not high, Al3 + hydrolysis generation A series of multi-hydrogen complexes, such as [Al2 (H2O) 6 (OH) 3] 3 +, [Al3 (H2O) 6 (OH) 6] 3 + and so on, even if the acidity will be increased to EDTA Titration of Al3 +The maximum acidity, can not avoid the generation of complex multi-core. The aluminum complex and multi-EDTA complex slow and complex than a constant, the titration of the negative. To avoid these problems could be back titration. If the first increase in over a certain amount of EDTA standard solution in the pH ≈ 3.5, the solution to boil, due to higher acidity at this time, it is not conducive to the formation of hydrogen-based multi-core complex, due to excess EDTA more, it can Al3 +EDTA complex and completely, totally complex, the solution pH adjustment from 5 to 6, (at this time AlY stability, and will not re-analysis of water out of complex multi-core), joined the XO can be successful with the Zn2 + standard solution for back titration. The method is user-friendly andhigh accuracy, in line with the basic requirements of the experiment.
Key words alum, back titration, acidity, complex complete, the indicator
1 引言
KAl(SO4)2·12H2O俗称明矾或白矾,是一种无色透明的晶体,其溶液呈弱酸性,常用作净水剂、食品添加剂,在工农业、食品加工业中有着重要的作用。
目前国内外测定食用明矾中铝的含量主要有三种方案:
第一种方案是直接滴定法:即DCTA(环己烷二胺四已酸)在室温下与Al3+迅速定量络合。这种方法操作简便,但所使用的DCTA价格比较昂贵[1]。
第二种方案为置换滴定法:此法用于测定像合金,硅酸盐,水泥和炉渣等复杂试样中铝的含量,以此提高选择性 。在pH=3-4时,加入定过量的EDTA溶液煮沸使Al3+与EDTA充分配合,冷却后调PH至5-6,以二甲酚橙为指示剂,用Zn标准溶液滴定过量的EDTA(不记体积)至微红色,然后加入过量的NH4F,加热至沸,使AlY-与F-之间发生置换反应,并释放出与Al3+配合的EDTA,然后用Zn2+标准溶液滴定,直至锥形瓶中颜色变为紫红色,即为终点 [2]。
AlY-+6F-+2H+ = AlF63-+H2Y2-
第三种方案为返滴定法:此法用于简单试样如明矾,氢氧化铝,复方氢氧化铝片,氢氧化铝凝胶等药物中铝含量的测定。由于Al3+ 易形成一系列多核羟基络合物,这些多核羟基络合物与EDTA络合缓慢,且Al3+ 对二甲酚橙指示剂有封闭作用,故通常采用返滴定法测定铝。加入定量且过量的EDTA标准溶液,先调节溶液pH至3~4,煮沸几分钟,使A13+ 与EDTA络合反应完全。冷却后,再调节溶液pH至5~6,以二甲酚橙为指示剂,用Zn2+ 标准溶液滴定至溶液由黄色变为橙色,即为终点 [3]。
第四种方案为分光光度法:此法的测定条件是在pH = 7时,铝在十六烷基三甲基溴化铵和聚乙二醇辛基苯基醚溶液(OP乳化剂)存在下,与铬天青S反应生成绿色的四元混合胶束,于630 nm处比色定量。其中对样品进行处理:将粉丝剪碎后,于85℃烘箱中干燥2h,取出冷却至室温后,准确称取2.00 g样品于瓷坩埚中,加入少量水浸润,置于电炉上慢慢炭化至不再冒烟,再于550℃电阻炉中灰化4h,冷却后取出,用10mL (1+5)盐酸溶液溶解灰分,转移至100mL容量瓶中,用蒸馏水定容。标准曲线绘制及样品测定:取1.00mL样品溶液于25mL比色管中,加入2mL 1%氨水液。另取7支25mL比色管,依次加入0.10、0.25、0.50、1.00、2.00、4.00、8.00mL铝标准使用液,即含有铝0.10、0.25、0.50、1.00、2.00、4.00、8.00μg ,分别加入1mL 1%氨水溶液。然后在标准管和样品管中分别加入1mL 1%的抗坏血酸溶液,1mL 1.0g/L的铬天青S溶液,混匀后再加入1mL (3+100)OP乳化剂,1mL 3.0g/L的十六烷基三甲基溴化铵溶液,2mL 200g/L的乙酸铵缓冲液,加蒸馏水至25mL,混匀。室温放置30 min后,于分光光度计上,用1cm比色皿以试剂空白为参比在630nm处测量吸光度值[4]。
第五种方案为重量分析法:精确称取三份明矾试样(2g左右)与250mL的烧杯中,按如下方法处理:
加热溶解烧杯中的明矾试样,直至溶液澄清。调节pH=3~9。往烧杯中滴加0.2mol/L的8-羟基喹啉至过量,此时溶液产生沉淀。
Al3+ +3C9H7ON =Al(C9H6ON)3 ↓+3H+
抽滤分离沉淀,将沉淀定量转入瓷坩埚中,高温灼烧1小时后,置于干燥器中冷却,分析天平生恒重至相邻两次质量差为2mg。称得的质量即为Al2O3的质量[5]。
比较上述五种方案可知,第三种方案操作简便易行且准确度较高,故本实验采用第三种方案返滴定法:即先调节溶液pH至3~4,加入定过量的EDTA溶液,煮沸,冷却,再调节溶液pH至5~6,以二甲酚橙为指示剂,用Zn2+ 标准溶液滴定至溶液由黄色变为橙色。
2 实验原理
明矾KAl(SO4)2·12H2O中Al的测定,可采用EDTA配位滴定法。由于Al3+ 易形成一系列多核羟基络合物,这些多核羟基络合物与EDTA络合缓慢,且Al3+ 对二甲酚橙指示剂有封闭作用,故通常采用返滴定法测定铝,加入定量且过量的EDTA标准溶液。
因为氢氧化铝的溶度积常数KSP=1.3×10-33,[A13+]=0.020mol/L,

所以冷却后,再调节溶液pH至5~6(此时AlY稳定,也不会重新水解析出多核络合物),以二甲酚橙为指示剂,用Zn2+ 标准溶液滴定至溶液由黄色变为橙色:Zn + Y = ZnY,即为终点。
滴定完毕后,计算公式为:
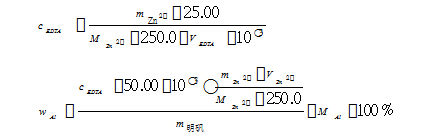
3 实验用品
3.1 仪器
全自动电光分析天平,酸式滴定管﹙50mL﹚,电子秤,容量瓶(100 mL 、250mL各一个),锥形瓶(250mL三个),烧杯﹙500 mL﹚,胶头滴管,玻璃棒,塑料试剂瓶,电炉,量筒,移液管﹙25 mL﹚,表面皿,称量瓶,药匙
3.2 药品 明矾 [KAl(SO4)2·12H2O] 试样,乙二胺四乙酸二钠盐(Na2H2Y·2H2O),二甲酚橙指示剂(2g/L),六亚甲基四胺溶液(200g/L),盐酸溶液(1︰1),基准锌粒(99.9%),pH=3.5的缓冲溶液
4 实验步骤
4.1 溶液的配制
4.1.1 0.02mol/LEDTA的配制
用电子秤称取约3.72g固体EDTA二钠盐于500mL的烧杯中,加入蒸馏水加热使其完全溶解,然后加水稀释至500mL。冷却后转入塑料试剂瓶中,盖紧瓶塞,摇匀备用。
4.1.2 0.02mol/L Zn2+标准溶液的配制
用分析天平准确称取含Zn99.9%以上的基准锌粉0.3~0.4 g于小烧杯中,盖上表面皿,沿烧杯嘴滴加约10mL(1︰1)HCl溶液,加热煮沸至完全溶解(防止蒸干)后,用少量水淋洗表面皿及烧杯内壁,然后将溶液定量转移至250mL容量瓶中,稀释至刻度,摇匀备用。根据数据计算Zn2+标准溶液的准确浓度。
4.2 EDTA标准溶液的标定
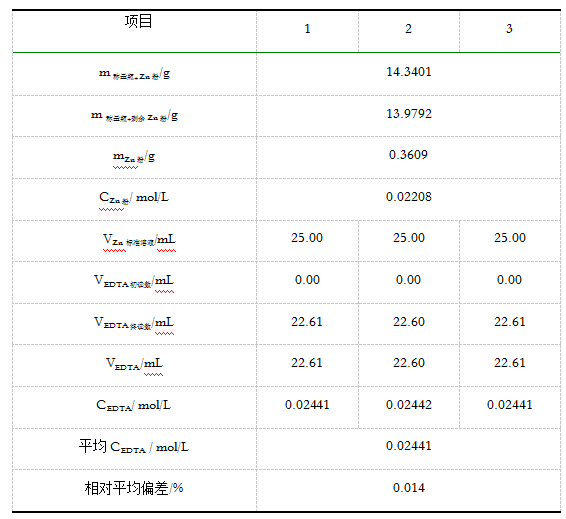
用移液管平行移取三份25.00mLZn2+标准溶液分别置于250mL锥形瓶中,滴加2滴二甲酚橙指示剂,加入10mL20%的六亚甲基四胺溶液,用EDTA溶液滴定,直至锥形瓶中溶液颜色由紫红色恰好转变为亮黄色,并持续30s不褪色即为终点。记录所用EDTA溶液的体积,并计算EDTA溶液的浓度和相对平均偏差(≤0.2%)。
4.3 明矾试样中Al含量的测定
用分析天平准确秤取明矾试样[ KAl(SO4)2·12H2O, Mr=474.4 ]0.95~1.00g于小烧杯中,加热使其完全溶解,待冷却后将溶液定量转移至100mL容量瓶中,用蒸馏水稀释至刻度,摇匀备用。
用移液管移取25.00mL明矾试样标准溶液置于250mL的锥形瓶中,用滴定管准确加入EDTA标准溶液50.00mL,然后加入10mL pH=3.5的缓冲溶液,在电炉上加热煮沸近10min,然后放置冷却至室温。
在锥形瓶中加入六亚甲基四胺10mL,二甲酚橙指示剂3~4滴,用Zn2+标准溶液返滴定至溶液由黄色变为橙色,并持续30s不褪色即为终点。
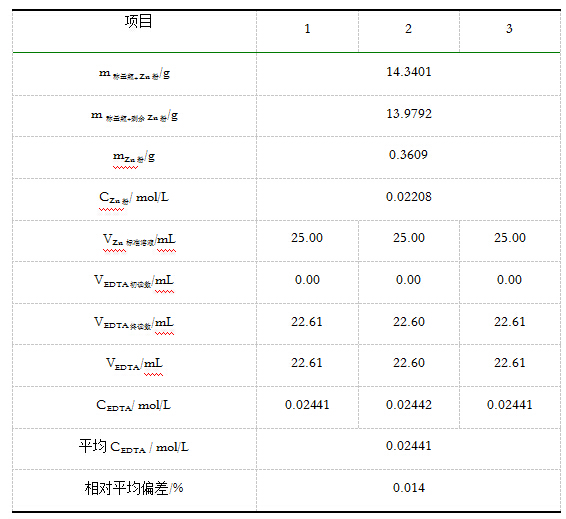
平行测定三份,根据所消耗的Zn2+标准溶液的体积,计算所测明矾中铝的含量和相对平均偏差(≤0.2%)。
5 实验记录及数据处
5.1 0.02mol/EDTA溶液的标定
5.2 明矾试样中Al含量的测定
6 实验结果与讨论
6.1 测定结果
本实验采用返滴定法测定明矾中铝的含量,其中所配制的Zn2+标准溶液的浓度为 0.02208mol/L ,所标定EDTA的标准浓度为 0.02441mol/L ,明矾中铝的含量为 5.70% 。 ﹙明矾中铝的理论含量为 5.69% ﹚。实验所得结果与理论值较接近,说明此实验方法较好。
6.2 误差分析
6.2.1 分析天平仪器老化,灵敏度不高,有系统误差;
6.2.2 滴定过程中,有少量溶液滞留在锥形瓶内壁,未用蒸馏水完全冲入溶液中,导致误差;
6.2.3 滴定过程中滴定终点判断有误,读数时有人为误差;
6.2.4 试剂纯度可能不够和蒸馏水中可能含有微量杂质从而引起系统误差。
6.3 注意事项
6.3.1 pH<6时,游离的二甲酚橙显黄色,滴定至Zn2+稍微过量时,Zn2+与部分二甲酚橙生成紫红色配合物,黄色与紫红色混合呈橙色,故终点颜色为橙色;
6.3.2 注意滴定时指示剂的用量,及滴定终点颜色的正确判断;
6.3.3 注意滴定时的正确操作:滴定成线,逐滴滴入,半滴滴入;
6.3.4 明矾溶于水后,因缓慢溶解而显浑浊,在加入过量EDTA并加热后,不影响滴定;
6.3.5 确定滴定终点时,要注意在规定时间内不退色再读数;
6.3.6 处理数据时注意有效数字的保留。
参考文献
[1] 蔡维平.基础化学实验(一)[M].北京:科学出版社,2004,298
[2] 武汉大学,吉林大学,中山大学,中国科学技术大学.分析化学实验(第五版)[M].北京:高等教育出版社,2001,209
[3] 宋光泉.通用化学实验技术[M].广州:广东高等教育出版社,1999,85
[4] 文建国,常慧,徐勇军.基础化学实验教程[M].北京:国防工业出版社,2006,97-98
[5] http://jc2.ecjtu.jx.cn/huaxue/te/uploadfile/2008428161533257.doc
最新消息
- 1赛多利斯新品Practum系列天平
查看次数:1283079......
- 22014年中国和世界十大科技进

由中国科学院、中国工程院主办,中国科学院院......
- 3天美中国与国家纳米科学中心

5月29日下午,天美(中国)科学仪器有限公司与......
- 4分析天平应该如何选砝码以及

查看次数:1107677 分析天平应该如何选砝......
- 5电子天平的使用与维护方法

电子天平是最新一代的天平,是根据电磁力平衡......
