顶空单滴微萃取与高效液相色谱联用检测环境样品中的多环芳烃
顶空单滴微萃取与高效液相色谱联用检测环境样品中的多环芳烃
摘 要 :本文建立了一种以饱和β-环糊精水溶液作为萃取溶剂的顶空液相微萃取-高效液相色谱分析多环芳烃的新方法。通过β-环糊精与多环芳烃的包结作用对样品中的五种半挥发性多环芳烃进行了分离富集。对影响萃取效率的重要因素进行了考察。在最优的条件下,该方法对五种多环芳烃(萘,菲,蒽,荧蒽和芘)的检出限分别为0.097, 0.016, 0.004, 0.247, 0.098ng/ml,相对标准偏差(RSDs)为5.1-7.1%( n=7)。实验结果表明:β-环糊精既能提高对多环芳烃的萃取效率,又能增强高效液相色谱荧光检测信号。将本法应用于合成水样和环境样品(水样和树叶样品)的分析,结果令人满意。该方法简单,快速,选择性高,且无需有机溶剂,可用于复杂基体中痕量多环芳烃的分析。
关键词:顶空单滴微萃取;高效液相色谱;多环芳烃;β-环糊精;环境样品
1 引言
多环芳烃(Polycyclic aromatic hydrocarbons,简称PAHs)是环境中普遍存在的一种持久性污染物。由于其具有强烈的致癌和变异作用,美国环保总署(简称EPA)确定了16 种PAHs作为优先监测污染物。PAHs 主要来源于石油、煤等燃料及木材,可燃气体的不完全燃烧。
它在环境中分布很广,PAHs 通过大气、水、食品、吸烟等进入人体,严重地影响人类的健康。因此,人们对多环芳烃的研究给予了足够的重视[2,3,4]。准确测定环境中多环芳烃化合物的含量具有十分重要的意义,然而在环境中多环芳烃存在的浓度很低,而且环境样品基体复杂,干扰物多,不容易直接测定,通常需要对样品进行前处理。因此,寻找快速、简便、高效、高灵敏度的前处理方法一直分析化学研究的热点。
目前,用于测定环境中多环芳烃的样品前处理方法有很多,已有报道的方法有:索氏提取(Soxhlet extraction、液-液萃取(liquid-liquid extraction)、超声波萃取(ultrasonicextraction)、加速溶剂萃取(accelerated solvent extraction, ASE)、微波辅助萃取(microwave assisted extraction, MAE)、超临界流体萃取(supercritical fluid extraction, SFE)和固相萃取(solid phase extraction, SPE)[9-12]。前三种方法都需要消耗大量的有
机溶剂,对环境造成很大的压力,而且费时。后四种方法虽能有效减少有机溶剂消耗量并缩短操作时间,但这些方法须使用特殊的仪器设备,分析成本高。
液相微萃取技术是一种快捷、有效、低成本和溶剂量消耗少的样品前处理技术。该法可分为直接液相微萃取和顶空液相微萃取[17]两种模式。其中顶空液相微萃取适用于分析物容易进入样品上方空间的挥发性或半挥发性有机化合物。与直接液相微萃取相比,顶空液相微萃取能消除样品基体的影响,因此,该法被广泛应用于环境样品中的挥发性与半挥发性有机污染物的分析[17-20]。
环糊精是一类由葡萄糖单元组成的大环化合物,分子内部有一孔穴,根据组成的单元个数不同,分为α,β,γ 三种类型。环糊精分子外部具有亲水性,故在水中具有一定的溶解度,但其内部孔穴具有憎水性,这种特性决定了它可以根据客体分子的大小选择性地结合有机分子,形成具有不同稳定程度的包结物[21,22]。1988 年,Blyshak[23]等采用γ-环糊精溶液萃取异丙醚中的多环芳烃,对苝,蒄的萃取效率可达到90 %以上。该研究还表明,环糊精可以根据其空腔大小选择性地萃取特定的多环芳烃。Husain 等[24]的研究表明,β-环糊精能够增强多环芳烃荧光检测的荧光强度。
本文的目的是将β-环糊精水溶液作为顶空微萃取的萃取溶剂,同时又将其作为荧光信号增强试剂。建立顶空液相微萃取技术与高效液相色谱荧光检测技术(HPLC-FLD)联用,测定环境样品中的五种多环芳烃(萘,菲,蒽,荧蒽和芘)的新方法。本工作详细探讨了顶空液相微萃取体系中重要实验参数(如:样品温度,单滴体积,搅拌速度,萃取时间,离子强度等)对萃取效率的影响;并将所建立的新方法用于环境样品中多环芳烃的测定。
2 实验部分
2.1 试剂和标准溶液
萘(分析纯),蒽(化学纯)分别购自天津市恒兴化学试剂制造有限公司和天津市光复精细化工研究所,菲由武钢焦化厂提供,芘(98%),荧蒽(95%)购自鞍山市天长化工有限公司.
标准储备液溶解于甲醇中制备而成:萘,菲,荧蒽,芘(1 mg/mL);蒽(0.25 mg/mL)。
储备液在4 oC 条件下保存。
甲醇(分析纯)购自山东禹王化工厂,使用前用0.45μm 微孔漏斗过滤,β-环糊精(分析纯)购自Sigma Aldirich 公司。
实验中所用的其它试剂均为优级纯或分析纯,18.2 MΏ 高纯水(Labconco system)用于整个实验过程。
所有容器在使用前均在10%硝酸中浸泡24 小时以上,使用前用高纯水冲洗干净。
2. 2 样品处理
天然水样:取东湖表面水(pH 7.7,武汉),分析前加入0.2 g/ml 的氯化钠,并用盐酸调节pH 值至5.0,经萃取直接注入高效液相色谱进行分离检测。
树叶:采集某焦化厂附近的树叶,捣碎。将准确称重的树叶用pH 值为5.0 的磷酸二氢钾/氢氧化钠缓冲溶液(含0.2g/ml 的氯化钠)浸泡24 小时,再经萃取直接注入高效液相色谱进行分离检测。
2. 3 顶空液相微萃取装置及萃取过程
本文采用顶空液相微萃取装置的示意图如1 所示:采用40oC 的水浴加热,将装有10 mL样品溶液的顶空瓶放在恒温磁力搅拌器(江苏荣华仪器制造有限公司)的正上方的水浴烧杯里。先用微量进样器抽取10μL 的饱和β-环糊精溶液,然后将该溶液在顶空瓶上方推至针尖,萃取一段时间后抽回液滴,直接注入高效液相色谱进行分离检测。
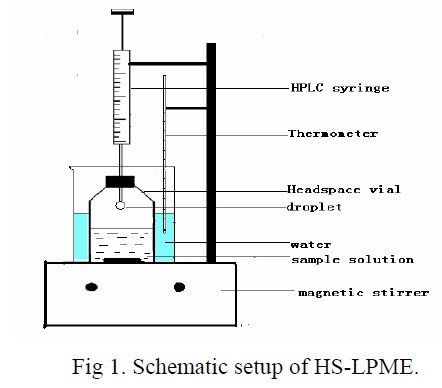
2. 4 HPLC 系统
本工作所使用的高效液相色谱仪为HanonLC7000二元高压色谱系统。色谱柱为RP-C18 柱(ODS,250mm×4.6 mm ,5-μm 粒径)。荧光检测的波长列于表1,以峰面积定量。采用等度洗脱,流动相为90%甲醇,10%水,在流速为1 mL/min 的条件下,五种多环芳烃能得到有效地分离与检测。
3 结果与讨论
考察了影响顶空液相微萃取效率的因素,包括微滴体积,搅拌速率,萃取时间,样品温度,离子强度,以及pH 值和β-环糊精浓度。
3.1 顶空液相微萃取条件优化
3.1.1 样品温度的影响
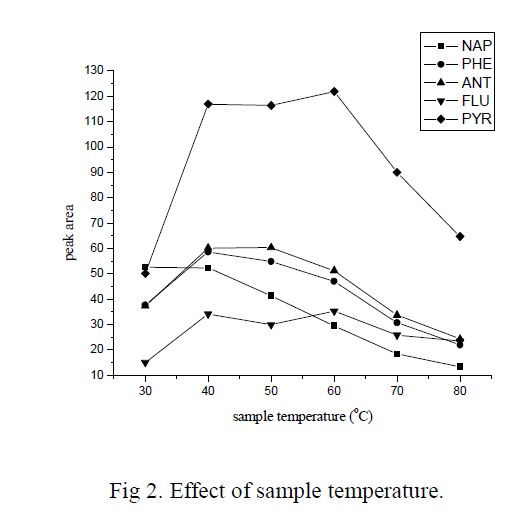
对于顶空萃取半挥发性物质来说,温度是一个重要影响因素。在本实验中,使用恒温水浴控制样品溶液的温度,考察了30oC-80oC 范围内温度对萃取效率的影响,结果如图2 所示。随着温度的升高,五种多环芳烃的信号强度都有明显的增强,但当温度大于40oC 时,荧蒽,芘的萃取效率不再增大,而萘,菲,蒽的萃取效率反而降低。一般情况下,升高温度可以加快分子运动, 导致液体蒸汽压的增大, 有利于缩短萃取的平衡时间[25]; 另一方面,β-环糊精与多环芳烃的包结是一个放热的过程[21],因此,升高温度反而使得萃取效率下降。综合考虑动力学和热力学的影响,实验中选择40oC 作为样品温度。
3.1.2 单滴体积的影响
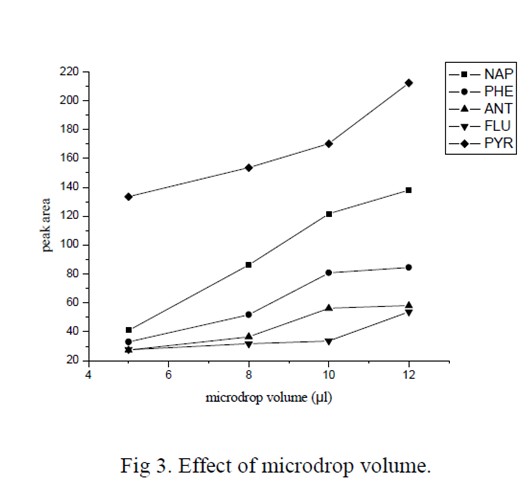
顶空液相微萃取一般采用有机溶剂作为萃取溶剂,本实验采用环糊精水溶液作为萃取溶剂,实现了完全绿色的萃取,且在萃取过程中液滴几乎没有挥发损失。实验中在微量进样器的针头上套有一节移液枪枪头,使得针头上可以悬挂较大体积的液滴。如图3 所示,当液滴体积在2-12μL 的范围内变化时,萃取效率随着微滴体积的增大而增大。然而,当液滴体积大于10μL 时,由于其自身的重力作用,液滴变得不稳定,因此本实验采用的萃取微滴体积为10μL。
3.1.3 搅拌速率的影响
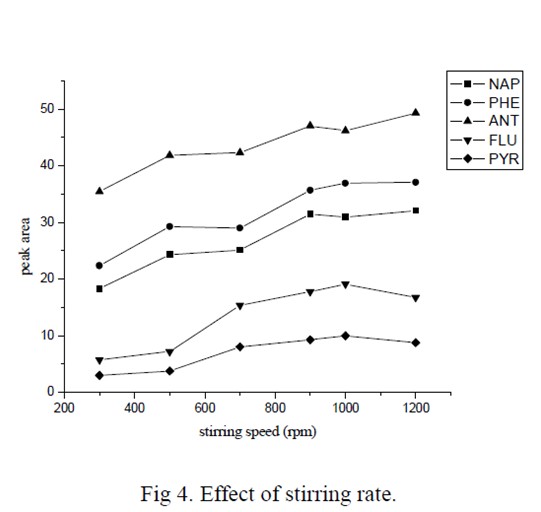
提高搅拌速率可以加速水相中分析物的挥发,以气态形式进入样品上部空间,缩短平衡时间,提高萃取效率。从图4 可以看出,随着搅拌速率的增加,待测物的萃取效率有明显的增大,当转速大于900 rpm 时,萃取效率变化不明显。因此,本实验选择1000 rpm 作为萃取搅拌速率。
3.1.4 萃取时间的影响
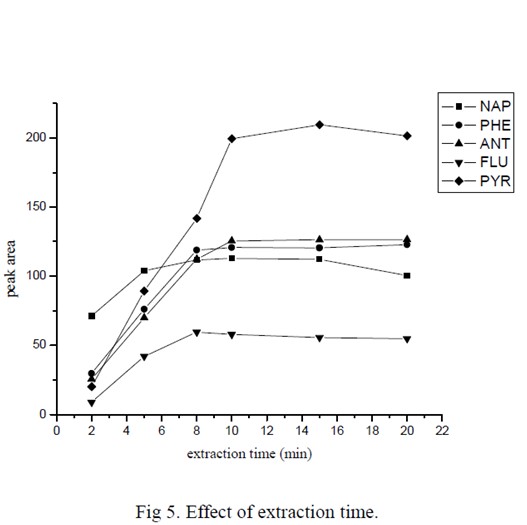
本方法采用环糊精与PAHs 的包结作用实现萃取,因此,萃取效率在很大程度上由包结作用的平衡常数决定。图6 是萃取时间对5 中PAHs 萃取效率的影响。可以看出,待测物信号强度在10 min 以后就不再增大,说明此时萃取已经基本上达到平衡。其中萘的信号强度在5 min 后就基本上趋于稳定,这跟萘的挥发性最好是相吻合的。基于上述实验结果,本文选择的萃取时间为10 min。
3.1.5 离子强度的影响
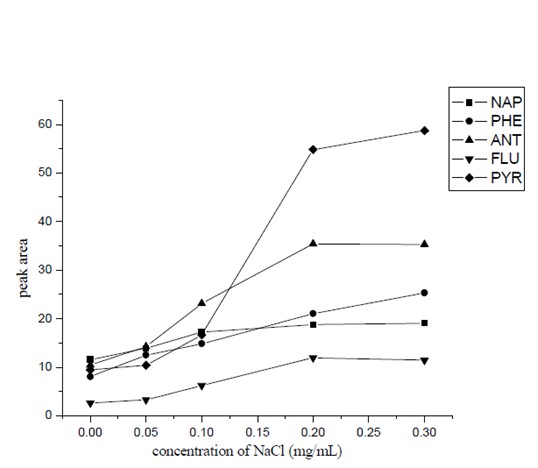
往样品溶液中加入盐类可以减小有机物的溶解度,从而使更多的待测物进入顶空提高萃取效率。在本实验中,考察了加入氯化钠的量对萃取效率的影响。由图6 可以看出,加入氯化钠的浓度在0-0.2 g/ml 范围内变化时,PAHs 的萃取效率随着氯化钠浓度的增加显著增大,而当氯化钠浓度大于0.2 g/ml,随着氯化钠浓度增加,萃取效率变化不明显。因此,在本实验中加入氯化钠的浓度为0.2 g/ml。
3.1.6 pH 值以及环糊精的影响
控制溶液的pH 值能够改变分析物在溶液中的存在形式,实验中用磷酸二氢钾/氢氧化钠缓冲溶液调节样品的pH 值,在pH4-10 的范围内,研究了pH 对PAHs 的萃取效率的影响。
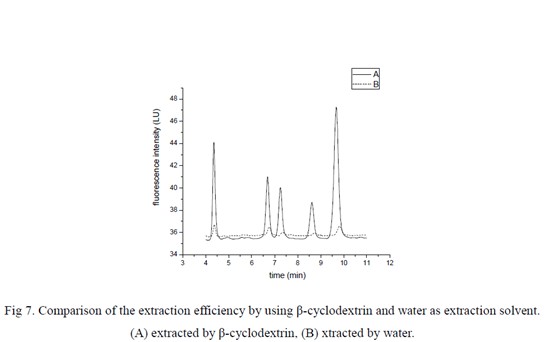
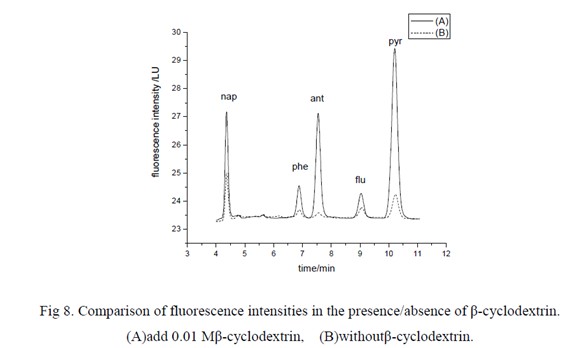
结果表明在低pH 范围内有较好的萃取效率,因此,本工作选择pH 值5 作为本实验样品溶液的pH 值。本实验研究了β-环糊精对萃取效率的影响。实验中分别用8μl 的水和β-环糊精饱和水溶液进行萃取,结果如图7 所示。曲线A 是8μl 的饱和β-环糊精水溶液萃取后,萃取相中再加入8μl 的水,混合均匀后注入HPLC 分离检测;曲线B 则是用8μl 的水萃取,萃取相在注入HPLC 之前加入8μl 的饱和β-环糊精水溶液。可以看出,A 所获得的信号强度远远大于B所获得的信号强度,这表明:β-环糊精对PAHs 有很好的萃取效果。
同时本实验还研究了β-环糊精浓度对萃取效率的影响,五种多环芳烃的萃取效率都随着β-环糊精浓度的增大而增大,因此在本实验中我们选择使用饱和的β-环糊精水溶液作为萃取溶剂。
3.2 β-环糊精的荧光信号改善作用
实验中考察了相同浓度的多环芳烃在不加和加入0.01 Mβ-环糊精时的荧光信号强度 。如图8 所示,在β-环糊精存在下的情况下,待测物的荧光信号强度均有明显的增强,β-环糊精的这种特性可以极大提高方法的灵敏度。
3.3 分析性能
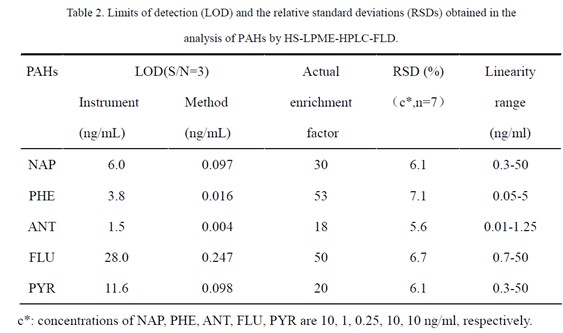
对方法的分析性能进行了考察,结果见表2。本方法的线性范围为0.01-50 ng/ml 之间,相应的相对标准偏差(RSD s)均低于10%;富集倍数分别为18-53 倍;检出限(S/N=3)在0.004-0.247 ng/ml 范围内。
3.4 样品分析
3.4.1 合成水样及实际水样
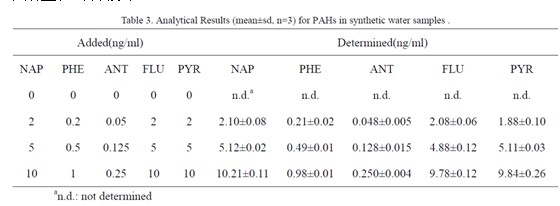
将所建立的方法用于合成水样的分析以验证方法的准确度和精密度,所得结果列于表3中。可以看出,当PAHs 的加入值在0.05-10 ng/ml 的范围内,测定值和期望值吻合较好。
将本实验所建立的方法应用于天然水样的分析,检测不到或不能定量水中的PAHs,因此将其加标后进行顶空液相微萃取和HPLC 直接分析,所得结果列于表4 中。
3.4.2 树叶样品
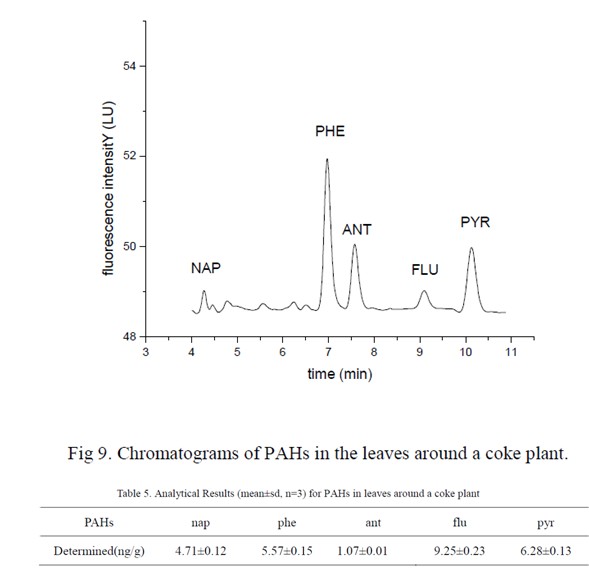
图9 和表5 是采集于某焦化厂附近的树叶中PAHs 的分析结果,结果表明焦化厂附近的树叶中含有1.07-6.28 ng/g 的萘,菲,蒽,荧蒽和芘。
4 结论
本文提出了采用饱和β-环糊精水溶液作为顶空液相微萃取的萃取溶剂,通过β-环糊精与多环芳烃的包结作用有效地萃取环境样品中的五种挥发性多环芳烃,HPLC 测定环境中PAHs 的新方法。实验结果表明:β-环糊精既能有效地提高对多环芳烃的萃取效率,同时又对多环芳烃的荧光信号有很好的改善作用。该方法简单,快速,灵敏度高,选择性好,且无需有机溶剂,可用于复杂基体环境试样中PAHs 的分析。
参考文献:
[1] R. Doong, S. Chang, Y. Sun, Solid-phase microextraction for determining the distribution of sixteen US Environmental Protection Agency polycyclic aromatic hydrocarbons in water samples,J. Chromatogr. A, 879(2000): 177-188.
[2] S. Waidyanatha, Y. Zheng, et al, Determination of polycyclic aromatic hydrocarbons in urine of coke oven workers by headspace solid phase microextraction and gas chromatography–mass spectrometry, Chem.-Biol. Interact., 145 (2003): 165-174.
[3] M. D. Guilen, P. Sopelana, Headspace solid-phase microextraction as a tool to estimate the contamination of smoked cheeses by polycyclic aromatic hydrocarbons, J. Dairy. Sci., 88 (2005): 13-20.
[4] S. Shariati-Feizabad, Y. Yamini, N. Bahramifar,Headspace solvent microextraction and gas chromatographic determination of some polycyclic aromatic hydrocarbons in water samples,Anal. Chim. Acta, 489 (2003): 21-31.
[5] O. P. Heemken, N. Theobald, B. W. Wenclawiak, Comparison of ASE and SFE with Soxhlet, Sonication, and Methanolic Saponification Extractions for the Determination of Organic Micropollutants in Marine Particulate Matter, Anal. Chem., 69 (1997): 2171-2180.
[6] P. Navarro, E. Cortazar, L. Bartolome, et al, Comparison of solid phase extraction, saponification and gel permeation chromatography for the clean-up of microwave-assisted biological extracts in the analysis of polycyclic aromatic hydrocarbons, J. Chromatogr. A, 1128 (2006): 10-16.
[7] P. K. Wong, J. Wang, The accumulation of polycyclic aromatic hydrocarbons in lubricating oil over time-a comparison of supercritical fluid and liquid-liquid extraction methods, Environ. Pollut. 112 (2001): 407-415.
[8] X. Jiang, K. L. Hian, Dynamic hollow fiber-supported headspace liquid-phase microextraction, J. Chromatogr. A, 1087 (2005): 289-294.
[9] J. B. Dallarosa, J. G. Monego, E. C. Teixeira, et al, Polycyclic aromatic hydrocarbons in atmospheric particles in the metropolitan area of Porto Alegre, Brazil, Atmos. Environ. 39 (2005): 1609-1625.
[10] N. Saim, J. R. Dean, et al, Extraction of polycyclic aromatic hydrocarbons from contaminated soil using Soxhlet extraction, pressurised and atmospheric microwave-assisted extraction, supercritical fluid extraction and accelerated solvent extraction,J. Chromatogr. A, 791 (1997): 361-366.
[11] L. Hou, H. K. Lee, Application of static and dynamic liquid-phase microextraction in the determination of polycyclic aromatic hydrocarbons, J. Chromatogr. A, 976 (2002): 377-385.
[12] H. W. Chen, Determination of Polycyclic Aromatic Hydrocarbons in Water by Solid-Phase Microextraction and Liquid Chromatography, Anal. Sci., 24 (2004): 1383-1388.
[13] L. Arthur, J. Pawliszyn, Solid phase microextraction with thermal desorption using fused silica optical fibers, Anal. Chem., 1990, 62, 2145
[14] G. Ouyang, Y. Chen, et al, Time-Weighted Average Water Sampling with a Solid-Phase Microextraction Device, Anal. Chem. 77 (2005): 7319-7325.
[15] H. Liu, P. K. Dasgupta, Analytical chemistry in a drop solvent extraction in a microdrop, Anal. Chem., 68 : 1817-1821.
[16] M. A. Jeannot, F. F. Cantwell, Solvent Microextraction into a Single Drop, Anal. Chem., 68 (1996): 2236-2240.
[17] Q. Xiao, B. Hu, Comparison of headspace and direct single-drop microextraction and headspace solid-phase microextraction for the measurement of volatile sulfur compounds in beer and beverage by gas chromatography with flame photometric detection, J. Chromatogr. A, 1125 (2006): 133-137.
[18] A. Tankeviciute, R. Kazlauskas, Headspace extraction of alcohols into a single drop, Analyst, 126 ( 2001): 1674-1677.
[19] C. L. Ye, Q. X. Zhou, X. M. Wang, Headspace liquid-phase microextraction using ionic liquid as extractant for the preconcentration of dichlorodiphenyltrichloroethane and its metabolites at trace levels in water samples , Anal. Chim. Acta, 572 (2006): 165-171.
[20] S. H. Sun, Z. H. Cheng, J. P.Xie, et al, Identification of volatile basic components in tobacco by headspace liquid-phase microextraction coupled to matrix-assisted laser desorption/ionization with Fourier transform mass spectrometry, Rapid Communications in Mass Spectrometry, 19(2005): 1025-1030.
[21] 童林荟 环糊精化学—基础与应用, 科学出版社,2001.
[22] M. T. Butterfield, R. A. Agbaria, and I. M. Warner*, Extraction of Volatile PAHs from Air by Use of Solid Cyclodextrin, Anal. Chem. 68(1996): 1187-1190.
[23] L. A. Blyshak, T. M. Rossi, G. Patonay, I. M. Warner, Cyclodextrin-modified solvent extraction for polynuclear aromatic hydrocarbons, Anal. Chem.,60(1988): 2127-2131.
[24] N. Husain, A. Y. Christian and I. M. Warner,Effect of co-modifiers in cyclodextrin-modified mobile phases on the reversed-phase high-performance liquid chromatographic separation of polyaromatic hydrocarbons ,J. Chromatogr. A, 699(1995): 73-83.
[25] H. Li, K. L. Hian, Application of static dynamic liquid-phase microextraction in the determination of polycyclic aromatic hydrocarbons, J. Chromatogr. A, 976(2002): 377-385.
最新消息
- 1赛多利斯新品Practum系列天平
查看次数:1283079......
- 22014年中国和世界十大科技进

由中国科学院、中国工程院主办,中国科学院院......
- 3天美中国与国家纳米科学中心

5月29日下午,天美(中国)科学仪器有限公司与......
- 4分析天平应该如何选砝码以及

查看次数:1107677 分析天平应该如何选砝......
- 5电子天平的使用与维护方法

电子天平是最新一代的天平,是根据电磁力平衡......
